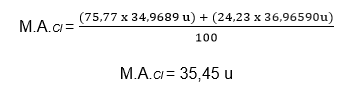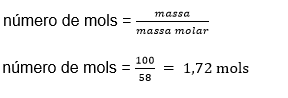Massa Atômica e Número de Mols
Nesse artigo vamos trazer os principais conceitos sobre Massa Atômica e Número de Mols, bem como alguns cálculos de Massa Atômica e Número de Mols.
Se está com dificuldades em compreender este conteúdo, nos acompanhe, vamos tirar suas dúvidas!
O que é Massa Atômica? Qual a Unidade de Massa Atômica?
A massa atômica é caracterizada como a massa de um átomo e sua simbologia é determinada por M.A.
Um átomo é muito pequeno, impossível de ver a olho nu. Sendo assim, medir a massa de um átomo totalmente inconcebível, não é verdade?
Dessa forma, cientistas estudaram muito sobre como determinar a massa de um átomo e chegaram à conclusão de que isso poderia ser feito comparando-se os átomos. Como assim?
Esse tipo de comparação é feito também com outros tipos de unidades. Veja o seguinte exemplo: massa de 1Kg corresponde a massa de um cilindro de 3,917 cm de diâmetro e altura.
Portanto, se pegarmos um objeto e pesarmos, e sua massa for de 10Kg, isso quer dizer a massa desse objeto é dez vezes maior que a massa do cilindro padrão para 1Kg.
Se pensarmos na massa de átomos, o processo é parecido. Os cientistas para determinar a massa de um átomo, elegeram o átomo de carbono-12 como padrão para seus cálculos.
Qual a Massa do Carbono?
Dessa forma, determinou-se que a massa de um átomo de carbono-12 equivale a 12 u. Assim sendo, a unidade de massa atômica é “u” e é igual a 1/12 da massa do átomo de carbono-12. Portanto:
1 u = 1/12 da massa de um átomo de C-12
Assim, determinando que a massa de um átomo de hidrogênio é igual a 1 u, é a mesma coisa de que dividir o átomo de carbono em 12 partes e uma dessas partes equivale a massa do átomo de carbono.
A mesma coisa pode ser dita para o átomo de sódio é 23 u, isso quer dizer que a massa de um átomo de sódio é 23 vezes maior que 1/12 da massa de do carbono-12.
Como Calcular Massa Atômica?
Com o passar do tempo e com os avanços da tecnologia, os cientistas conseguiram determinar com mais precisão o valor exato da massa de um átomo de cada elemento químico.
Os cientistas então, conceberam que 1u = 1,66054×10-24 g. Dessa forma, quando verificamos que a massa atômica do sódio é 23u. Em gramas, um átomo de sódio tem massa igual a 38,19242×10-24 g.
Massa Atômica na Tabela Periódica
Quando olhamos a massa atômica em uma tabela periódica percebemos que os valores nunca são exatos e, o que usamos em nossos cálculos é o valor aproximado.
Isso se deve ao fato de que a massa atômica é a média ponderada das massas de todos os isótopos desse elemento químico. Dessa forma, a massa atômica é calculada pela seguinte fórmula:
Veja o exemplo do cálculo da massa atômica do átomo de cloro:
Até hoje são conhecidos, dois isótopos do átomo de cloro: o Cloro-35 e o Cloro-37. O átomo de cloro-35 tem massa atômica igual a 34,9689u e sua ocorrência é de 75,77%. Enquanto o átomo de cloro-37, tem massa igual a 36,9659u e ocorrência de 24,23%.
Sendo assim, a massa atômica do átomo de cloro é:
Dessa forma, a massa atômica do cloro que encontramos na tabela periódica é de 35,45u.
Número Atômico e Número de Massa
O número atômico (Z) é o número de prótons que existem dentro do núcleo do átomo de determinado elemento químico.
O número de massa (A), ao contrário do que você deve estar pensando, não é massa do átomo de determinado elementos, mas, sim, a quantidade de partículas significativas que existem dentro do núcleo de um átomo.
Ou seja, o número de massa equivale a quantidade de prótons e nêutrons de um átomo de um elemento químico.
A = p + n
Massa Atômica x Massa Molecular
Massa molecular (M.M) nada mais é que a somatória das massas dos átomos constituintes de uma molécula.
Massa Atômica x Massa Molar
Massa molar é a massa em gramas de um mol de substância.
Aproveite e saiba mais:
A seguir vamos trazer informações sobre o que é mol e alguns exercícios para elucidar melhor esses conceitos.
O Que é Mol? Número de Mols?
Mol é uma das unidades do Sistema Internacional de Unidades e é utilizada para determinar a quantidade de material de um sistema.
Essa unidade foi criada em 1896 pelo químico Wilhem Ostwald, cujo o nome da unidade advém do latim mole que quer dizer quantidade.
Já químico Frances Jean Baptiste Perrin no início do século XX determinou que a unidade mol deveria ser equivalente a uma determinada quantidade de matéria e, após muito estudos, concluiu que
1 mol = 6,02 x 10-23 átomos ou moléculas (Número de Avogadro)
Sendo assim,
1 mol de Cloro = 6,02 x 10-23 átomos de cloro
1 mol de Cloreto de Sódio (NaCl) = 6,02 x 10-23 moléculas de NaCl
Exercícios de Massa Molar
- Determine a massa molar da partícula de NaCl.
Dados Massa atômica: Na = 23 u; Cl = 35 u
Massa molar de NaCl = (23) + (35)
Massa molar de NaCl = 58 g/mol
- Determine a massa molar de cloreto de prata AgCl , sabendo que a M.A de Ag = 108 u e Cl = 35
Resposta: 143g/mol
Exercícios de Mol
- Quantas partículas de NaCl existem em 100 g de sal de cozinha?
Como calculado no exercício 1, a massa molar do NaCl é de 58g/mol, sendo assim
- Quantidade de partículas de NaCl em 100g =
Número de Avogadro x número de mols de 100g
6,02×10-23 x 1,72 mols = 1,035×10-22 partículas de NaCl
- Quantas moléculas existem em 350 g de cloreto de magnésio (MgCl2)?
M.A. Mg = 24 u
Respostas:
2) 143g/mol
4) 2,24×10-22 moléculas de MgCl2