Cálculo de pH de Uma Solução: Como Calcular
Nesse artigo vamos trazer os principais conceitos sobre Cálculo de PH de Uma Solução, o que e, como calcular.
Se está com dificuldades em compreender este conteúdo, nos acompanhe, vamos tirar suas dúvidas sobre cálculo de PH de uma solução.
O que é pH?
Na química, pH é uma escala numérica que caracteriza a basicidade ou acidez de uma solução aquosa.
Assim, o pH determina o potencial hidrogeniônico das soluções, ou seja, o pH é responsável por determinar a concentração de íons H+ em uma solução, dessa forma, caracterizando essa solução como básica, ácida ou neutra.
Se o pH determina a concentração de íons H+ em uma solução, na química, existe também o pOH, o potencial hidroxiliônico, que indica a concentração de íons OH- em uma solução.
Apesar de menos usado, assim como o pH, o pOH caracteriza uma solução como sendo neutra, ácida ou básica.
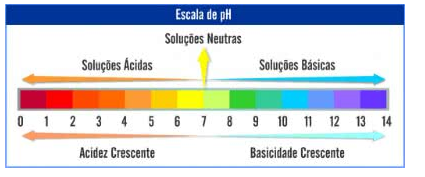
A seguir, observe a escala de pH, a mais utiliza para a caracterização de soluções.
A escala de pH apresenta valores que variam de 0 a 14. Dessa forma, soluções com pH igual a 7, se caracterizam por serem soluções neutras.
Já soluções com pH variando entre a 0 – 6, são ácidas, e conforme, mais perto do zero, mais ácida será a solução.
E, solução com pH variando entre 8 – 14 se caracterizam pela sua basicidade, e quanto mais perto do pH 14, mais básica ou alcalina será a solução.
Aproveite e saiba mais:
O nosso cotidiano está repleto de soluções que apresentam caráter básico, ácido ou neutro.
Por exemplo, o suco gástrico presente no estômago, que ajuda na digestão dos alimentos; os sucos de laranja; vinagre; o tomate; o café e o leite de vaca apresentam pH ácido.
O sangue humano; a água do mar; pasta de dentes; alguns produtos de limpeza, como desinfetantes e leite magnésia, são algumas soluções que apresentam caráter básico. A água pura é o maior exemplo de solução neutra.
Calculo de pH envolvendo uma Solução e o Uso de Logaritmos no Cálculo de pH
Os cálculos que envolvem o pH de soluções têm por objetivo determinar a concentração de H3O+ ou H+ e OH–.
Sendo assim, nesses cálculos podemos utilizar equações logarítmicas de base 10 da seguinte forma,
pH = – log [H+] ou pH = – log [H3O+]
Simplificando essas equações obtemos:
[H3O+] = 10-pHEssa simplificação só pode ser utilizada quando o valor do pH for inteiro, caso não seja, deve-se utilizar a função logarítmica acima.
Dessa forma, quando calculamos o pH de uma solução, esses cálculos se relacionam também o potencial hidroxiliônico, ou seja, com o pOH, visto que tanto o pH quanto o pOH se relacionam com a autoionização da água e com a lei de diluição de Ostwald, que vamos conhecer a seguir.
- Autoionização da água:
Na autoionização da água ocorre a liberação dos íons H+ e OH– e a constante de ionização Kw tem valor igual a 10-14
Sendo assim, Kw = [H+] . [OH–] = 10-14
Dessa forma: pH + pOH = 14
Cálculo de pH com Diluição
- Segundo a Lei de Ostwald, quanto mais diluída estiver a solução, maior será a quantidade de íons H+ livres, assim, é possível pode-se determinar a quantidade de que uma determinada substancia pode se dissociar ou ionizar em água.
- A fórmula segundo a Lei de Ostwald é a seguinte:
Ki = M.α2
Ki = Constante de ionização de uma substância
M = Concentração molar da substância
α2 = grau de dissociação ou ionização
Dessa forma, podemos classificar uma solução de básica, ácida ou neutra da seguinte forma:
A 25 ºC
Em uma solução neutra, pH = 7, a concentração de íons H+ e OH– é igual.
[H+] = [OH-], pH= 7Em uma solução ácida, pH entre 0 e 6, a concentração de íons H+ é maior que a concentração de OH–
[H+] > [OH-], pH entre 0-6Em uma solução básica, pH entre 8-14, a concentração de íons H+ é menor que a concentração de OH–
[H+] < [OH-], pH entre 8 – 14Calcular pH a Partir da Concentração
A concentração de íons H+ ou H3O+ em uma solução de suco de tomate é igual a 1,0×10-4, determine o pH dessa solução.
De acordo com a seguinte equação [H3O+] = 10-pH, podemos determinar o valor do pH do suco de tomate:
[H3O+] = 10-pH1.10-4 = 10-pH
10-4 = 10-pH
-4 = -pH
pH = 4
Portanto, o suco de tomate apresenta pH = 4, solução ácida!
Cálculo de pH de uma Solução Diluída
Determine como o Cálculo de PH de Uma Solução de vinagre, a uma concentração molar de 0,030 mol/L de ácido acético, supondo que o seu Ki = 1,8.10-5?
Dados: log 7 = 0,84
Para determinar a concentração de ions H+ é necessário conhecer a concentração molar (dado pelo exercício) e o grau de ionização que vamos determinar agora.
Ki = M.α2
1,8×10-5 = 0,030.α2
α2 = 1,8×10-5 / 0,030
α = 2,4×10-2
Assim, para determinar a concentração de íons H+
[H3O+] = M x α[H3O+] = 0,030 x 2,4×10-2
[H3O+] = 7,0×10-4 mol.L-1
Com a [H3O+], podemos determinar o pH da solução diluída de ácido acético:
pH = – log [H3O+]
pH = – log 7.10-4
pH = 4 – log 7
pH = 3,16, solução ácida!
Como calcular pH e pOH
(VUNESP) A 25 °C, o pOH de uma solução de ácido clorídrico, de concentração 0,10 mol/L, admitindo-se ionização total do ácido, é:
Dados (a 25 °C): [H+ ] [OH- ] = 1,0×10-14; pOH = -log [OH- ]
HCℓ → H+ + Cℓ–
0,1M 0,1M 0,1M
pH = -log[H+ ]
pH = -log10-1
pH = 1
pH + pOH = 14
pOH = 14 – 1
pOH = 13
Exercícios
- Adicionou-se água a 1,15 g de ácido metanóico até completar 500 mL de solução. Considerando que nessa concentração o grau de ionização desse ácido é de 2%, então o pOH da solução é:
Dada a massa molar do ácido metanóico = 46 g/mol
- Admita que café tem pH = 5,0 e leite tem pH = 6,0.
Sabendo-se que pH = -log [H+] e que pH + pOH = 14, calcule a concentração de OH– no café.
Respostas:
1)pOH = 11; 2) [OH- ] = 10-9 M
Gostou e aproveite e compartilhe sobre cálculo de PH de uma solução.